最近、テレビのコマーシャルなどでよく目にする「ジェネリック医薬品」。しかし、効き目や安全性についての疑問も聞かれます。そこで、先発医薬品との相違点、品質確保のしくみなどについて紹介します。
ジェネリック医薬品は、新薬(先発医薬品)の特許が切れた後に、他の医薬品メーカーから新たに製造販売される医療用医薬品(医療機関で診療を受けた時に処方される医薬品)で「後発医薬品」とも言われます。ジェネリック医薬品は、先発医薬品と同じ有効成分を同じ量含有していて、効能・効果や用法・用量も先発医薬品と変わりません。先発医薬品と効き目や安全性が「同等」であり、先発医薬品と代替可能な医薬品であることを厚生労働大臣が承認したものだけが、ジェネリック医薬品として供給されています。
ジェネリック医薬品は、一つの先発医薬品に対して複数のメーカーから発売されています。また、ジェネリック医薬品の種類は、高血圧、高脂血症、糖尿病、アレルギー用薬など様々な病気や症状に対応するものが開発されており、医薬品の剤形もカプセル、錠剤、注射剤等多岐にわたっています。 |
|
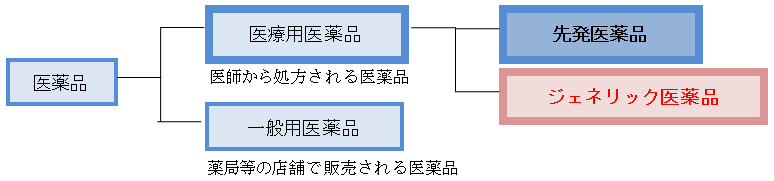
図1 医薬品の分類
|
|
先発医薬品の開発には、長い年月と莫大な投資費用が必要とされており、研究開発にかかるコストが薬の価格にも反映されています。一方、ジェネリック医薬品の場合は、先発医薬品において有効性や安全性が既に確認されている有効成分を利用するため、開発期間やコストを大幅に抑えられ、薬の価格も先発医薬品より安く設定することができます。
ジェネリック医薬品には、先発医薬品よりも飲みやすくなるように、薬の大きさや味、臭いを改良したり、湿気や光に対する安定性等の品質を改善し保存性の向上に工夫を加えたものもあります。また、製品によっては、先発医薬品と異なる添加剤を使用していることがあります。このような場合でも、先発医薬品と効果や安全性に違いが生じないことが試験によって確認された製品だけが製造販売を認められています。
ジェネリック医薬品の審査は、先発医薬品の場合と同様の規格値と試験方法(有効成分の確認、含量、純度、溶出性等)、安定性試験に加え、生物学的同等性試験1)によって評価されます。
1)生物学的同等性試験:ジェネリック医薬品が先発医薬品と治療学的に同等であることを証明するために実施する試験。ヒト(健康成人)に先発医薬品とジェネリック医薬品を常用量投与して、両者の血中濃度の推移に統計学的な差がないことを確認する。また、経口製剤では、溶出挙動が生物学的同等性に関する重要な情報を与えるので、溶出試験を実施する。
試験の実施、同等性の評価は「後発医薬品の生物学的同等性試験ガイドライン」に基づいて行う。
|
厚生労働省はジェネリック医薬品の品質を確保するため、平成10~18年度に「医薬品品質再評価事業」、平成19年度からは「後発医薬品品質情報提供等推進事業」を実施しています。神奈川県衛生研究所では、これらの事業に関連して国立医薬品食品衛生研究所に設置されている「ジェネリック医薬品品質情報検討会」の製剤ワーキンググループに参加し、検討会で品質を確認する必要があるとされた製剤について試験を実施しています。また、平成20年度から市場に流通しているジェネリック医薬品の品質を確認するために厚生労働省が実施している「後発医薬品品質確保対策事業」に協力し、「溶出試験」を実施しています。様々な品質検査のうち、当所で実施している「溶出試験」について説明します。 |
一般的な飲み薬の場合、医薬品の有効成分は胃や腸等の消化器官内で吸収され、血液中に移行します。有効成分が血液中に移行する速度(時間)と量が、薬の効き目の違いの要因の一つであると考えられています。同じ有効成分が同じ量含まれている医薬品でも、錠剤を作る時の強度や、有効成分以外に含まれている賦形剤やコーティング剤等の添加剤の違いによって、有効成分が消化器官内で溶け出す度合い(溶出特性)に違いが生じて、薬の効き目が違ってくる可能性があります。 |
「溶出試験」は消化器官内で、医薬品製剤から有効成分がどのように溶け出すかを、in vitro (試験管内)で再現する試験です。「溶出試験」は固形医薬品の品質管理試験の一つとして用いられるほか、先発医薬品とジェネリック医薬品のような異なる医薬品間での溶出特性が類似しているかどうかを評価する目的で、ヒト試験の同等性を補強するデータとして用いられています。
溶出試験器の一例を図2に示しました。容器内の温度が37±0.5℃となるように恒温水槽等内に設置したガラス等の透明な容器(ベッセル)内に適切な試験液を入れ、医薬品を投入して撹拌部(パドル)を回転させ、一定時間内に試験液中に溶け出す有効成分の量(濃度)を高速液体クロマトグラフ等で測定します。先発医薬品との類似性の確認のために実施するジェネリック医薬品の品質確保試験では、「後発医薬品の生物学的同等性試験ガイドライン」に準じて、試験液には、水及び消化器官内での生理的pHの範囲(酸性、弱酸性、中性)の4種類を用いて溶出試験を行っています。試験液の液性による溶け出し方の違いの例を図3に示しました。また、異なる医薬品間における類似性の有無についての例を図4に示しました。 |

図2 溶出試験器の一例
|
|
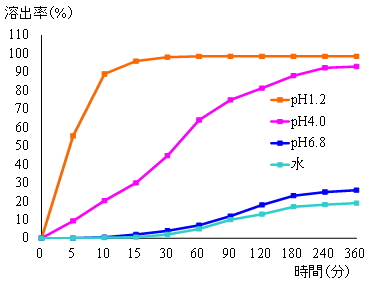
図3 試験液の液性による溶出挙動の違い
|
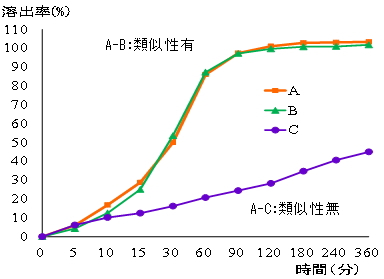
図4 医薬品間の類似性の有無
|
|
「後発医薬品品質確保対策事業」の検査結果は、厚生労働省のホームページに公表されています。また、「ジェネリック医薬品品質情報検討会」での検討結果は、国立医薬品食品衛生研究所及び独立行政法人医薬品医療機器総合機構のホームページで公表されています。
|
ジェネリック医薬品の普及は、薬代の削減につながることから、健康保険料や国の財政負担削減への貢献が期待されています。そこで、厚生労働省はジェネリック医薬品のさらなる使用促進を図るため、平成25年4月に「後発医薬品のさらなる使用促進のためのロードマップ」を策定し、平成30年3月末までにジェネリック医薬品の数量シェアを60%以上にするという新たな目標を設定しました。これに伴い情報提供の取り組みとして、平成26年4月から医療関係者だけでなく、ジェネリック医薬品を使用する人々を対象に「後発医薬品品質情報」を発行しています。
また、神奈川県保健福祉局生活衛生部薬務課では、県民の皆様にジェネリック医薬品についての理解を深めていただき、上手にジェネリック医薬品を使っていただくよう、広報活動を行っています。当所では、薬務課との連携の下、今後も医薬品の品質確保に関する調査研究を進め、これらの研究で得られる医薬品の品質情報を適確に提供することにより、流通する医薬品の安全性確保に役立てたいと考えています。 |
| |
|
|
|
|
| |
|
発行所
|
神奈川県衛生研究所(企画情報部) |
| 〒253-0087 茅ヶ崎市下町屋1-3-1 |
| 電話(0467)83-4400 FAX(0467)83-4457 |
|
|
|





